近年来,病毒载体介导的基因治疗领域迅速发展,包括体内外直接疗法和基于细胞的方法。然而,基因治疗在商业成功之路上也面临诸多挑战。本文将探讨基因治疗药物商业化进程需要战略和技术制造创新支持的三个非常重要的领域。如果我们要克服当前供需失衡,有效地发挥基因治疗的巨大潜力,在这些关键领域的成功将是至关重要的。
DOI:
10.18609/cgti.2020.011
引用:细胞和基因治疗洞察力2020;6(2),85–92
基因治疗的现状与展望
病毒载体驱动的基因治疗领域,结合体内和体外细胞为基础的治疗方法,近年来取得了巨大的增长。第一个获得全球市场认可的突破性CAR-T细胞疗法(诺华公司的Kymriah®和KITE制药公司的Yescarta®)为过去24个月基因治疗的进一步发展铺平了道路,包括第一个获得美国FDA批准的以AAV为载体的体内基因治疗药物,Luxturna®(SparkThera-peutics )。
在适应症方面,肿瘤仍然占主导地位,约占所有细胞和基因治疗产品的62%。然而,孤儿单基因疾病治疗也在体内基因治疗中得到了很好的表现,并且,也有越来越多的适应症在患者群体更庞大的心血管和传染病等关键治疗领域。
基因治疗临床管线的发展与基因治疗公司的估值上升步伐一致。从吉列德公司以119亿美元收购Kite制药公司到现在,已经过去了2年,这种趋势持续不减。
当然,基因治疗朝着商业成功方向的速度发展面临着挑战,尤其是在病毒载体制造领域。
任何生物产品的生产,无论是单克隆抗体还是基因治疗药物,都有一些重要的考虑因素:原料,设备和耗材是否符合GMP生产是至关重要的;设备和每个工艺步骤的可扩展性同样重要;稳健性和重现性是商业上可行的生物工艺的先决条件。
然而,基因治疗总体的更新速度,加上许多候选产品目前正在加速进程的事实意味着生物过程/CMC发展窗口正在有效地缩小。除了这种加速需求之外,基因治疗开发商和制造商必须面对的现实是基因疗法生物工艺在很大程度上仍来自学术界,呈现上游和下游的质量问题,重现性和可扩展性问题。不仅如此,目前许多的制造设备是来自单克隆抗体领域,虽然这些设备的有效更新正在进行,并且针对基因治疗生产的特定需求正在出现新的解决方案,这仍然是一项并未完成的工作。
最后,基因治疗药物的生产是一个高度复杂的领域。有不同的载体类型,这些载体的多个血清型(特别是AAV)都可用于基因治疗药物的制造。此外,病毒载体的生产目前涉及多个细胞系的使用。这种标准化的缺乏与成熟的单克隆抗体生产形成了鲜明对比,其仅围绕CHO细胞和一个相对明确的、基于生物反应器的上游和下游工艺配合。
本系列将探讨3个需要生产策略和生产工艺创新以支持基因治疗药物商业化的重要领域:
·可扩展性和再现性
·测试与质量
·生产场地的法规要求
如果我们要克服目前的供需失衡,有效地发挥基因治疗的巨大潜力,这三方面的成功将是至关重要的。
一、可扩展性和再现性
我们可以将基于哺乳动物细胞培养的病毒载体生产过程分为三个主要阶段:上游生产、中游处理和下游纯化。上游生产通常从细胞种子复苏和扩增步骤开始,使用贴壁或悬浮培养。接下来是生产阶段,以感染细胞或转染细胞的方式产生病毒载体。
中游处理其开始于病毒载体收获步骤。可能需要进行裂解以从细胞中提取病毒载体,或者病毒载体已经释放到培养基中。另外,也可以是两种方式的结合——这取决于所生产的病毒和特定的工艺。
而在澄清操作去除细胞碎片前使用Benzonase®可以最大程度减少宿主蛋白。同样,根据工艺和生产规模,可能有必要在这一环节进行浓缩步骤,以及通过适当的缓冲液进行换液。下一步是下游纯化,其主要目的是去除污染物并获得高纯度产品,以在终端制剂、过滤和灌装完成之前对产品进行浓缩。
当然,有必要对整个过程进行测试,包括为此所需提供的样品量。在上游生产过程中,起始体积足够大,意味着可以满足检测所需,但是随着生产流程的进行,体积变小,产品变得越来越珍贵——设计一个取样和检测计划是很重要的。
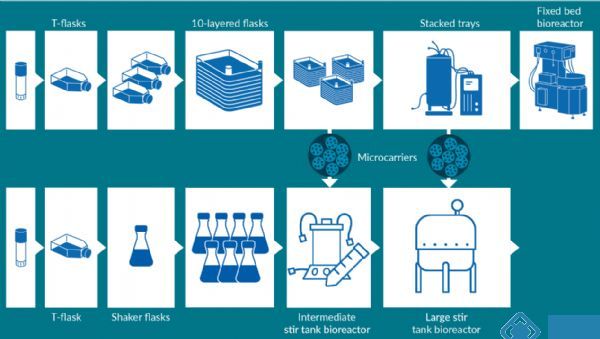
这类流程通常在小规模下运行良好,但随着需求的增加,生产更多检测样品的需求也随之增加。一种方法是线性扩展(Scale out):多次进行相同定义的单元操作。这是一个好主意,因为它是已知的单元操作工作。以贴壁细胞扩增为例,可以从T型瓶开始,然后进入一个稍大的容器,比如分层T型瓶。同样的概念也适用于悬浮细胞,从最初的摇瓶或转瓶,扩大到多个转瓶。然而,这种方法有一定的局限性,主要瓶颈是所需的空间和操作数量,洁净室空间与培养箱数量有限,所需的劳动量也是进一步的限制因素。因此,上述方法只适用于中小型生产。
有必要考虑一种不同的方法,即比例扩展(Scale up)。比例扩展与线性扩展概念相同,即更大的表面积,但是需要更多地关注单元操作和流程本身。例如,对于贴壁细胞的放大,同样的原理:从T型瓶开始,然后转移到10层T型堆,以及可以再次到更大表面积的36层超堆栈,然后重复多个这样的操作单元。对于悬浮细胞,可以使用摇瓶,然后转入小型生物反应器(例如摇床或小型一次性生物反应器),最后过渡到中型搅拌生物反应器。这是一种稍微改进的方法,最终仍然会遇到同样的瓶颈,即没有足够的空间来进行所有的单元操作。因此,比例拓展是一种可行的方法,但只适用于中期规模到或许大规模生产初期。
新技术的出现有可能实现真正的大规模生产。这些技术涉及规模化的方法,但超越了传统的概念。例如,在过去,10层超堆栈可能被限制在每批约20或30个单元,而现在可以进入固定床生物反应器,占地面积小,但表面积可达500μm。类似地在悬浮细胞培养方面,最近生物反应器的创新也取得了巨大的进步。现在的生物反应器有各种各样的尺寸,从50升到2000升,具有与洁净室空间兼容的规格。虽然大型生物反应器在单克隆抗体领域中被长期使用,但是,对病毒载体的需求第一次达到了这样的水平,即大型生物反应器必然成为基因治疗的所需。
综上所述,近几年上游生产力有了很大的进步,现在越来越多的挑战来自于优化中间处理步骤和下游工艺开发:
·关于中间处理步骤,人们必须认识到包含了大量病毒载体的料液特点,例如发酵过程中所产生的污染物,相应地扩大澄清步骤;深入了解使用的流速、压力和剪切力;可能需要多个澄清滤器和多种类型的澄清滤器。这些规模相关的因素都需要由工艺开发小组来考虑。
·同样的考量也适用于下游纯化。在小试时,低污染负荷意味着只需要一个相对简单的纯化方案。然而重要的是要记住,浓度更高的产品伴随着更多的污染物,体积是下游处理的关键。还必须考虑生产过程中使用的培养基类型——所选择培养基的蛋白质组成在病毒产物与基质的结合中起关键作用。
病毒载体的大小和性质,以及压力和剪切力等因素必须在层析优化和/或纯化方案中被考虑。因为层析具有稳健性和可扩展性的特点,所以通常被推荐作为纯化的一种手段。在这个阶段有许多变量和选择:对于最终产品的使用要求决定了纯化所需的步骤;结合/洗脱可以聚焦在产品本身上,或者采用流穿模式对污染物进行分离,这些是影响过程稳健性的关键开发决策。一旦获得最终产品,要了解该产品的性质,以避免在最终过滤步骤中的大量损失(根据需要和工序,这可能紧接着最终制剂步骤)。
近年来病毒载体需求量迅速增加,为了达到更稳健、可扩展的过程,需要明确优化步骤。此外,在探索提高生产率的方法时,需要跳出思维定势。例如,固定床生物反应器有助于扩大贴壁培养,无需进行悬浮驯化,而这些工作是具有挑战性的,或者也可以考虑微载体悬浮技术。
总而言之,尽管病毒载体上游生产迄今为止可能集中了大多数焦点和创新,但是不要忘记中游和下游过程——以确保整体是可扩展的,而不仅仅是一个或两个组成部分。
值得注意的是,生产更大量的病毒载体并不是满足日益增长需求的唯一答案。基因传递和靶向的进一步创新和改进将导致未来需要的病毒载体数量减少,比如,转导效率的增加和/或传递系统的优化。最后,一些公司正在致力于改进培养基、缓冲液和其他组分,以便更好地维持细胞生长和病毒生产。